Исследователи обнаружили как повысить эффективность CAR-T-клеток, искусственных иммунных клеток, в борьбе с опухолями
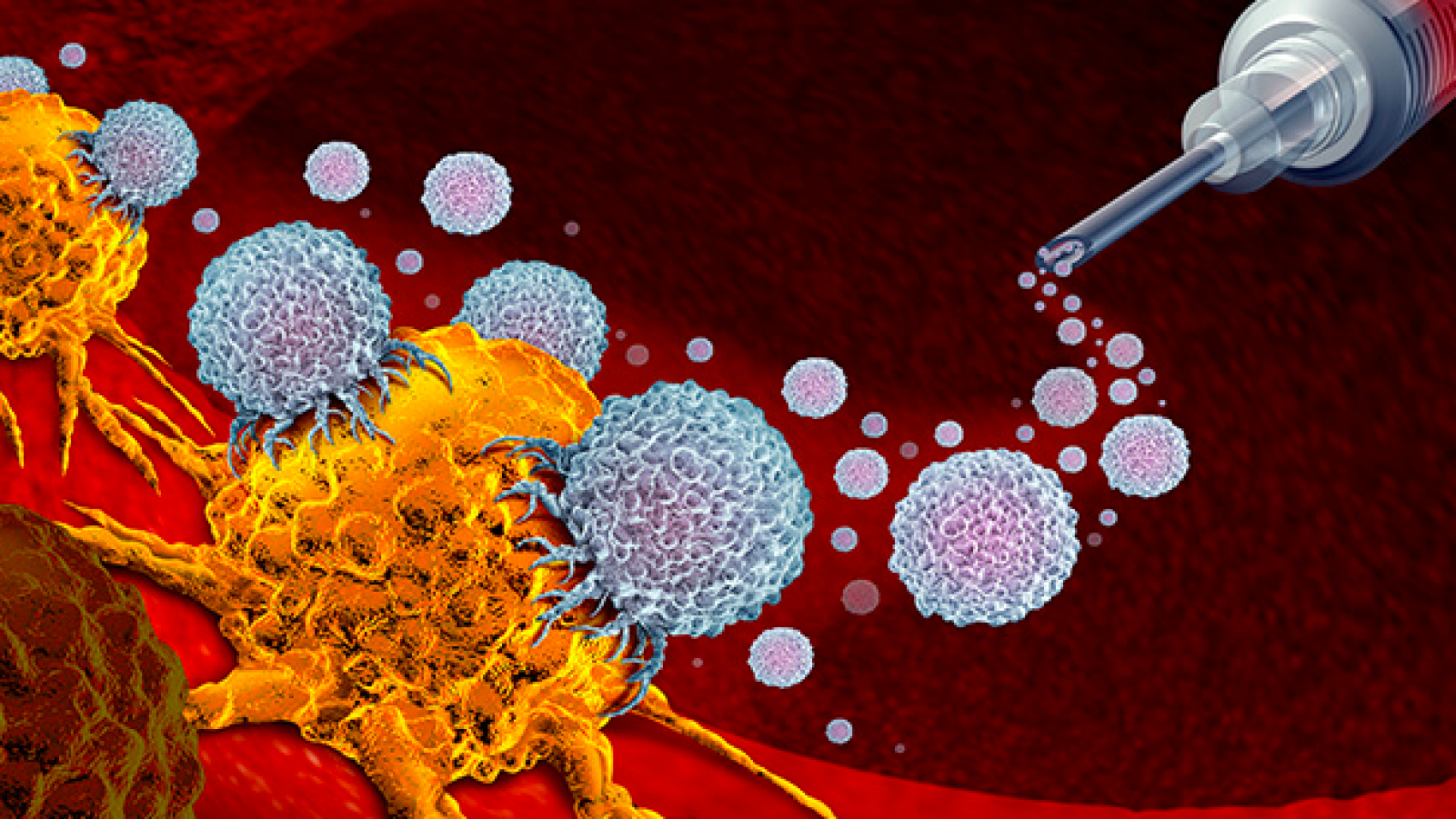
Среди доступных методов иммунотерапии использование клеток «CAR-T» показало значительную эффективность при лечении некоторых видов рака крови, но только у половины пациентов. Основная причина этого — преждевременная дисфункция этих иммунных клеток, искусственно модифицированных in vitro.
Совместная исследовательская группа из университетов Женевы (UNIGE) , Лозанны (UNIL), университетских больниц Женевы (HUG) и университетской больницы Во (CHUV), которые являются частью Швейцарского онкологического центра Лемана (SCCL), определила метод для продления функциональности CAR-T-клеток. Подавив очень специфический метаболический механизм, команде удалось создать CAR-T-клетки с улучшенной иммунной памятью, способные гораздо дольше бороться с опухолевыми клетками.
Эти очень многообещающие результаты были недавно опубликованы в журнале Nature .
Иммунотерапия CAR-T-клеток включает в себя взятие иммунных клеток (обычно Т-лимфоцитов) от человека, страдающего раком, модификацию их в лаборатории для повышения их способности распознавать опухолевые клетки и борьбу с ними, а затем повторное введение их пациенту. Однако, как и в случае с другими видами иммунотерапии, многие пациенты не реагируют на лечение или возникают рецидивы.
«CAR-T-клетки должны быть массово размножены, прежде чем их можно будет вводить», — объясняет Матиас Венес, научный сотрудник, который координировал это исследование в лаборатории доктора Дениса Мильорини, медицинского факультета медицинского факультета UNIGE и кафедры онкологии. в ОБЪЕМЕ. «Но история болезни пациента в сочетании с процессом амплификации истощает клетки: они достигают состояния терминальной дифференцировки, которое ускоряет конец их жизненного цикла, не оставляя им времени действовать на протяжении».
Механизм, общий для раковых клеток и иммунных клеток.
В отсутствие кислорода раковые клетки прибегают к очень специфическому механизму выживания: они метаболизируют аминокислоту глютамин как альтернативный источник энергии посредством химической реакции, известной как «восстановительное карбоксилирование». «Иммунные и раковые клетки имеют довольно схожий метаболизм, что позволяет им очень быстро размножаться. Мы действительно обнаружили, что Т-клетки также используют этот механизм», — объясняет Элисон Жаккард, доктор философии. студент лаборатории профессора Пинг-Чих Хо на кафедре онкологии UNIL-CHUV и первый автор исследования.
Чтобы исследовать роль восстановительного карбоксилирования, ученые ингибировали этот механизм в CAR-T-клетках на мышиных моделях лейкемии и множественной миеломы, двух видов рака крови. «Наши модифицированные CAR-T-клетки нормально размножались и не теряли своей способности атаковать, что указывает на то, что восстановительное карбоксилирование для них не является необходимым», — резюмирует Матиас Венес.
Мыши, вылеченные с помощью CAR-T
Более того, мыши, получавшие такое лечение, практически излечились от рака, что значительно превзошло ожидания исследовательской группы. «Без восстановительного карбоксилирования клетки больше не дифференцируются так сильно и дольше сохраняют свою противоопухолевую функцию. И даже, и это суть нашего открытия, они имеют тенденцию трансформироваться в Т-лимфоциты памяти, тип иммунных клеток, которые сохраняют память об элементах опухоли, которые необходимо атаковать».
Т-лимфоциты памяти играют ключевую роль во вторичном иммунном ответе. Они сохраняют память о ранее встречавшихся патогенах и могут реактивироваться при их повторном появлении – как в случае с вирусом , так и в случае с опухолевыми патогенами – обеспечивая гораздо более длительную иммунную защиту. «Тот же принцип применим и к CAR-T-клеткам: чем больше количество клеток памяти, тем эффективнее противоопухолевый ответ и тем лучше клинический результат. Таким образом, состояние дифференцировки CAR-T-клеток является ключевым фактором успеха лечения».
Перекрестная связь между метаболизмом и экспрессией генов.
В развернутом виде ДНК , содержащаяся в каждой из наших клеток, будет иметь длину около двух метров. Чтобы поместиться в крошечное ядро клетки, оно конденсируется вокруг белков, называемых гистонами. Чтобы произошла транскрипция гена, определенные участки ДНК должны развернуться, что происходит путем модификации гистонов.
Когда Т-клетки активируются, происходят модификации гистонов, которые, с одной стороны, конденсируют ДНК и предотвращают транскрипцию генов, обеспечивающих долголетие, а с другой стороны, открываются и позволяют транскрипцию генов, управляющих их воспалительной и убийственной функцией. Восстановительное карбоксилирование действует непосредственно на образование метаболитов, небольших химических элементов, которые модифицируют гистоны, влияют на упаковку ДНК и предотвращают доступ к генам долголетия. Его ингибирование поддерживает открытие этих генов и способствует их трансформации в CAR-T долгоживущей памяти.
Скоро клиническое применение?
Ингибитор, используемый учеными для блокирования восстановительного карбоксилирования, представляет собой препарат, уже одобренный для лечения некоторых видов рака. «Поэтому мы предлагаем изменить его положение, чтобы расширить его использование и производить более мощные клетки CART in vitro. Конечно, их эффективность и безопасность нуждаются в проверке в клинических исследованиях, но мы возлагаем очень большие надежды!», — заключают авторы.