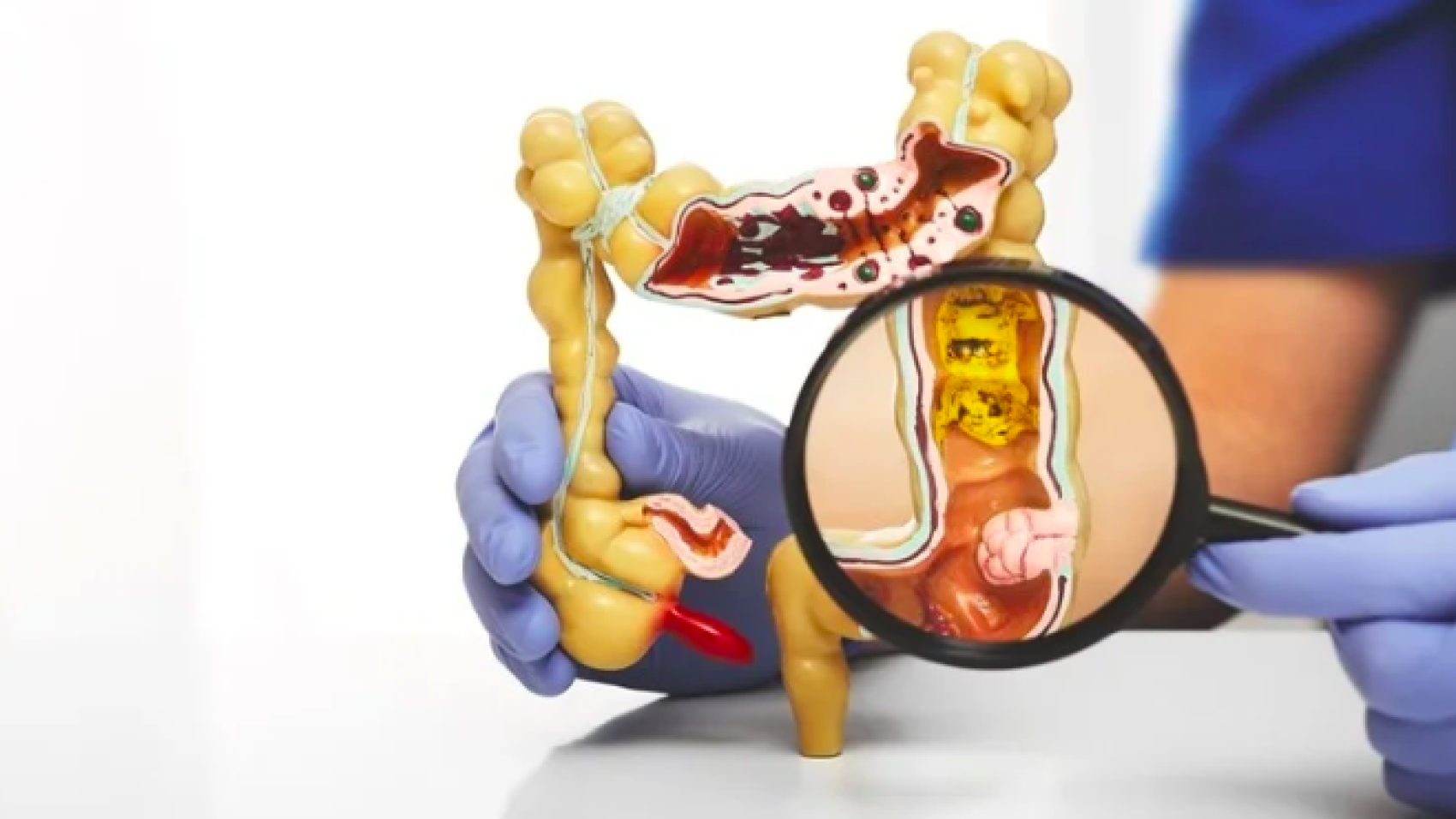
Результаты нового исследования показывают, что иммунотерапия может успешно использоваться для лечения наиболее распространенной формы колоректального рака, также известной как рак кишечника.
Результаты нового исследования, испытания фазы 1 с участием иммунотерапевтических препаратов ботенсилимаба и балстилимаба, были опубликованы в журнале Nature Medicine . пациенты.
В соавторстве с профессором Джастином Стеббингом из Университета Англии Раскин (ARU), который описывает результаты как «потенциально меняющие правила игры», исследование было сосредоточено на наиболее распространенном типе колоректальных опухолей, известном как MSS mCRC, или микросателлитно-стабильном метастатическом колоректальном раке.
Хотя ранее было показано, что иммунотерапия действует на пациентов с опухолями с дефицитом репарации специфических несоответствий (dMMR), только небольшой процент пациентов с колоректальным раком имеет этот тип опухоли, и иммунотерапия до сих пор неэффективна у пациентов с более распространенными опухолями mCRC MSS.
Новое исследование включало использование иммунотерапевтического препарата ботенсилимаба в сочетании с балстилимабом на группе пациентов в Соединенных Штатах. Оба эти препарата представляют собой моноклональные антитела , которые запускают иммунную систему организма для атаки на рак.
Из пациентов в исследовании фазы 1 101 принял участие в шестимесячном наблюдении, и из них у 61% наблюдалось уменьшение или сохранение опухоли после приема комбинации ботенсилимаба (BOT) и балстилимаба (BAL). Наиболее распространенными побочными эффектами или нежелательными явлениями, связанными с лечением, были диарея и усталость.
Стеббинг, профессор биомедицинских наук в Университете Англии Раскин (ARU) и автор исследования, сказал: «Эти результаты невероятно захватывающие. Колоректальный рак или рак кишечника является одной из наиболее распространенных форм рака во всем мире, и это происходит впервые. было убедительным доказательством того, что иммунотерапия может работать при всех формах колоректальных опухолей, так что это потенциально меняет правила игры.
«Сейчас это переходит в более позднюю фазу клинических испытаний, и мы надеемся, что FDA в Соединенных Штатах очень скоро одобрит его использование. И поскольку это такая важная область, затрагивающая так много людей, мы надеемся, что власти Великобритании также смогут принять меры быстро.»
Первый автор совместного исследования д-р Андреа Буллок, доцент кафедры медицины в Медицинском центре Бет Исраэль Диаконесса, сказала: «Это исследование проливает свет на потенциал комбинации BOT/BAL в лечении микросателлитного стабильного метастатического колоректального рака, наиболее распространенной формы колоректального рака. который исторически не реагировал на иммунотерапию, и мы надеемся, что наши результаты дадут новую надежду тем, кому поставлен диагноз».
Последний соавтор д-р Энтони Эль-Хуэйри, заместитель директора по клиническим исследованиям и руководитель отдела развивающей терапии Комплексного онкологического центра USC Norris, сказал: «Эта первая фаза исследования ботенсилимаба подчеркивает его многообещающую противоопухолевую активность, которая включает иммунологически холодовую активность. опухоли, такие как колоректальный рак MSS. Отмеченная эффективность подчеркивает потенциал ботенсилимаба за счет его более широкого воздействия на противоопухолевый иммунитет».
https://medicalxpress.com/news/2024-06-successful-trial-colorectal-cancer-treatment.html