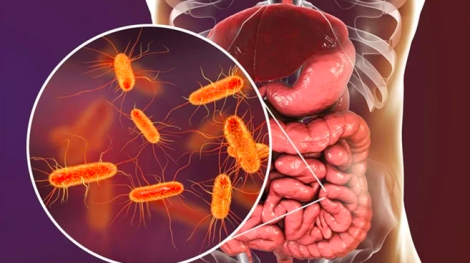
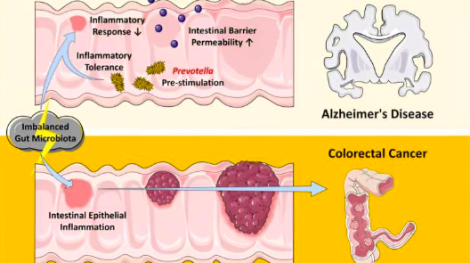
Передовые исследования выявили, как хронический стресс нарушает баланс микробиоты кишечника, ускоряя прогрессирование колоректального рака (КРР), что открывает новые возможности для профилактики и лечения КРР. Устранив определенные кишечные бакте ...
Россия, Московская область, Лапино.
1-е успенское шоссе, дом 111
1-е успенское шоссе, дом 111