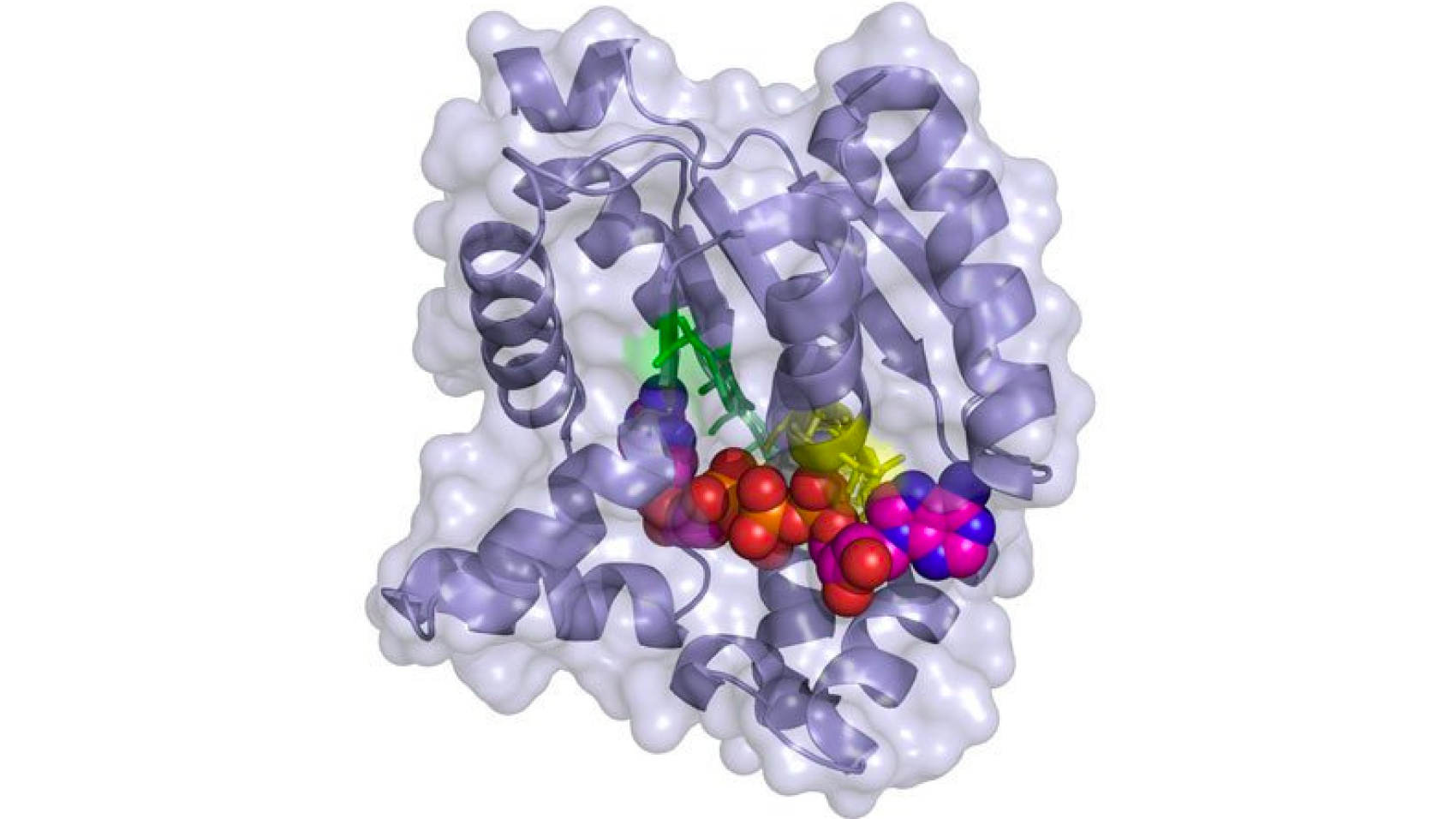
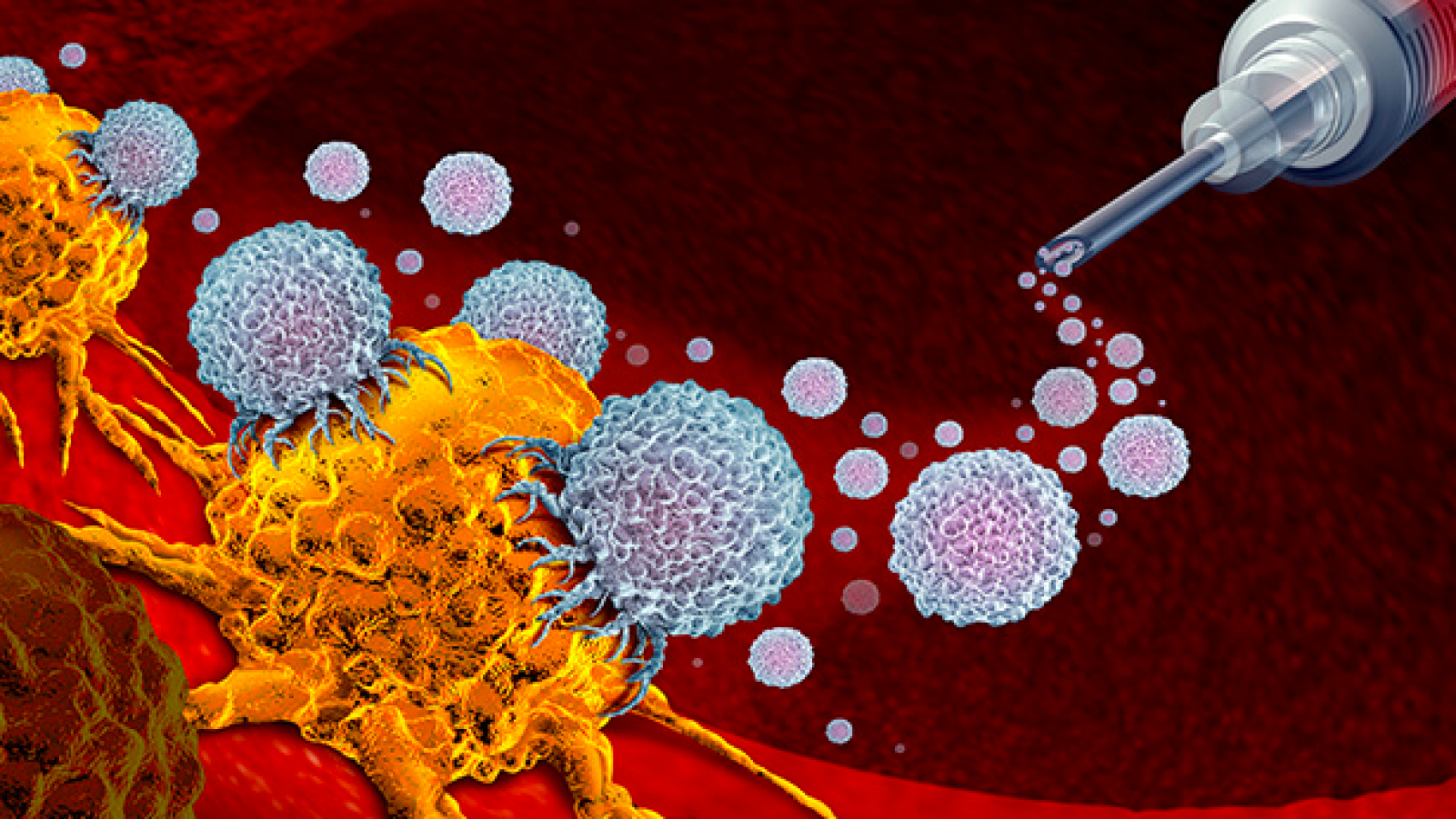
Исследование, опубликованное в Proceedings of the National Academy of Sciences , посвящено гену SRC-3, обнаруженному в типе иммунных клеток, известном как регуляторные Т-клетки (Treg).
Результаты исследования на животных, проведенного Медицинским колледжем Бэйлора, показали, что устранение гена SRC-3 в этих клетках инициировало стойкий противораковый ответ, который полностью удалял опухоли, более того, они не выявили каких-либо обычных побочных эффектов, обычно связанных с лечением рака.
«Эти эксперименты являются доклиническими и проводятся на мышах, но, тем не менее, они впечатляют по результатам», — сказал The National д-р Берт О’Мэлли, ректор и профессор молекулярной и клеточной биологии в Бэйлоре .
«Более 30 лет назад моя лаборатория обнаружила белок, который мы назвали коактиватором стероидных рецепторов (SRC), который необходим для эффективной регуляции активности генов», — сказал доктор О’Мэлли.
Команда доктора О’Мэлли проявила особый интерес к SRC-3 из-за его значительной роли в развитии рака.
Он высоко экспрессируется во всех раковых заболеваниях человека и заметно присутствует в Tregs, которые регулируют иммунный ответ на рак.
В то же время, Tregs, лишенные SRC-3, эффективно модифицировали среду, окружающую опухоль, способствуя ее устранению, и вызывали длительную реакцию по ликвидации опухоли. Внутри опухоли они высвобождали соединения, которые стимулировали иммунный ответ, способствуя проникновению других иммунных клеток, таких как Т-клетки и естественные клетки-киллеры, которые непосредственно атаковали опухоль.
Путем создания мышей с целенаправленно удалённым гена SRC-3 в Tregs исследователи смогли сравнить развитие рака молочной железы у этих животных с таковым у мышей, все еще сохраняющих ген SRC-3.
«Результаты нас удивили. Опухоли молочной железы были ликвидированы. Последующая инъекция дополнительных раковых клеток этим мышам не приводила к возникновению новых опухолей.Перенос этих клеток животным с ранее существовавшими опухолями молочной железы также привел к искоренению рака. Мы получили аналогичные результаты с раком простаты».
Доктор О’Мэлли объяснил потенциальное широкое применение результатов.
«Он удивительно широкий. Наши неопубликованные данные показывают, что он работает одинаково при раке поджелудочной железы и головного мозга, двух в настоящее время неизлечимых видах рака», — сказал он.
«Никакие другие методы лечения не дают такого эффекта на мышах в течение такого длительного периода времени. Мы надеемся, что это будет похоже на людей, когда это будет опробовано после одобрения».