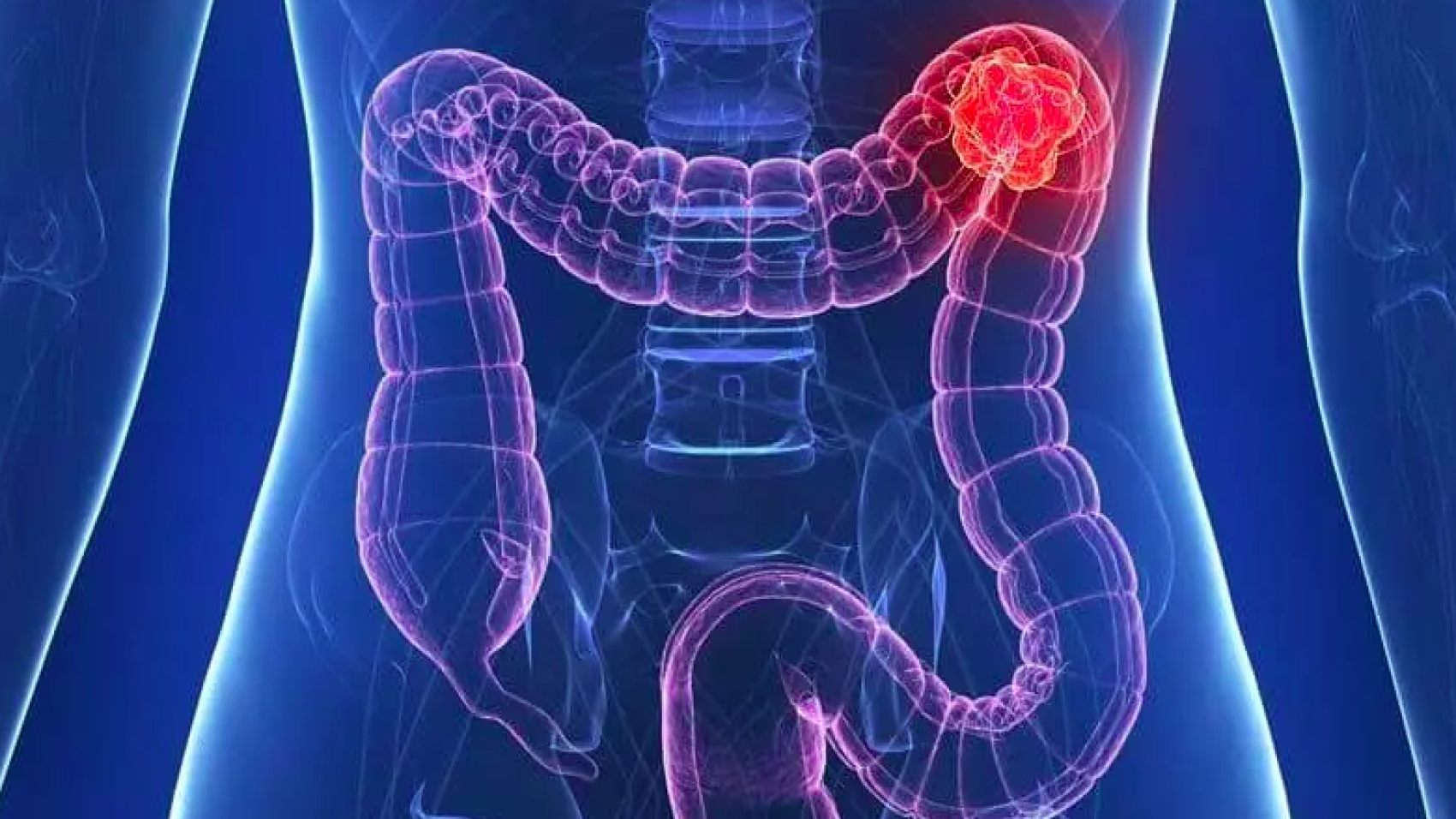
Новые исследования показывают , что революционные лекарства, такие как семаглутид, не только меняют правила игры в области снижения веса и лечения диабета — они входят в группу лекарств, которые могут предотвратить другие проблемы со здоровьем, такие как рак толстой кишки.
Семаглутид, продаваемый под торговыми марками Wegovy и Ozempic, представляет собой препарат, известный как агонист рецептора GLP-1. Препараты этой категории часто используются для регулирования уровня сахара в крови и контроля аппетита, а также воздействуют на гормон в организме, который помогает регулировать инсулин. Новейший класс этих препаратов — инъекции один раз в неделю, по сравнению с ежедневными инъекциями более старых вариантов, таких как лираглутид.
Исследователи из Университета Кейс Вестерн Резерв хотели посмотреть, как этот класс лекарств может сыграть роль в предотвращении рака толстой кишки по сравнению с другими лекарствами от диабета, поскольку эти заболевания могут идти рука об руку.
Они изучили данные более чем 1 миллиона пациентов с диабетом 2 типа, которым впервые были прописаны лекарства для его лечения в период с 2005 по 2019 год. Затем исследователи сравнили показатели диагностики рака толстой кишки между пациентами, принимавшими разные лекарства, за 15 лет наблюдения. вверх.
Согласно результатам, опубликованным 7 декабря в журнале JAMA Oncology , у пациентов, принимавших препараты GLP-1, риск развития рака толстой кишки был на 44% ниже, чем у пациентов, принимавших инсулин . Риск развития рака толстой кишки у участников был на 25% ниже, принимавших препараты GLP-1, чем метформин , популярный препарат от диабета, который также изучается как средство против старения.
По мнению исследователей , более высокий вес и индекс массы тела могут быть фактором риска развития рака толстой кишки , поэтому преимущества препаратов GLP-1 в управлении весом могут частично объяснить, как они помогают снизить риск развития рака. Тем не менее, они также обнаружили некоторую пользу у пациентов, у которых не было проблем со здоровьем, связанных с весом.
Результаты обнадеживают, поскольку рак толстой кишки является второй по значимости причиной смертности от рака, а данные свидетельствуют о том, что число диагнозов растет, особенно среди молодых людей.
Все большее число исследований посвящено тому, как лекарства GLP-1 могут со временем повлиять на наше здоровье.
Другие недавние исследования показывают, что эти лекарства могут также снизить риск сердечных приступов, инсультов и смертельных сердечно-сосудистых заболеваний , которые являются основными причинами ранней смерти.
Другие формы препаратов GLP-1, включая пероральные версии лекарств , все еще находятся на стадии клинических испытаний или других стадиях исследований.
Хотя эти препараты считаются безопасными, ожидаются дополнительные исследования их возможных долгосрочных эффектов, и они обычно имеют краткосрочные побочные эффекты, такие как тошнота, запор или диарея.
https://vk.com/groups?z=audio_playlist746866125_77%2F2a264edc7886e20472