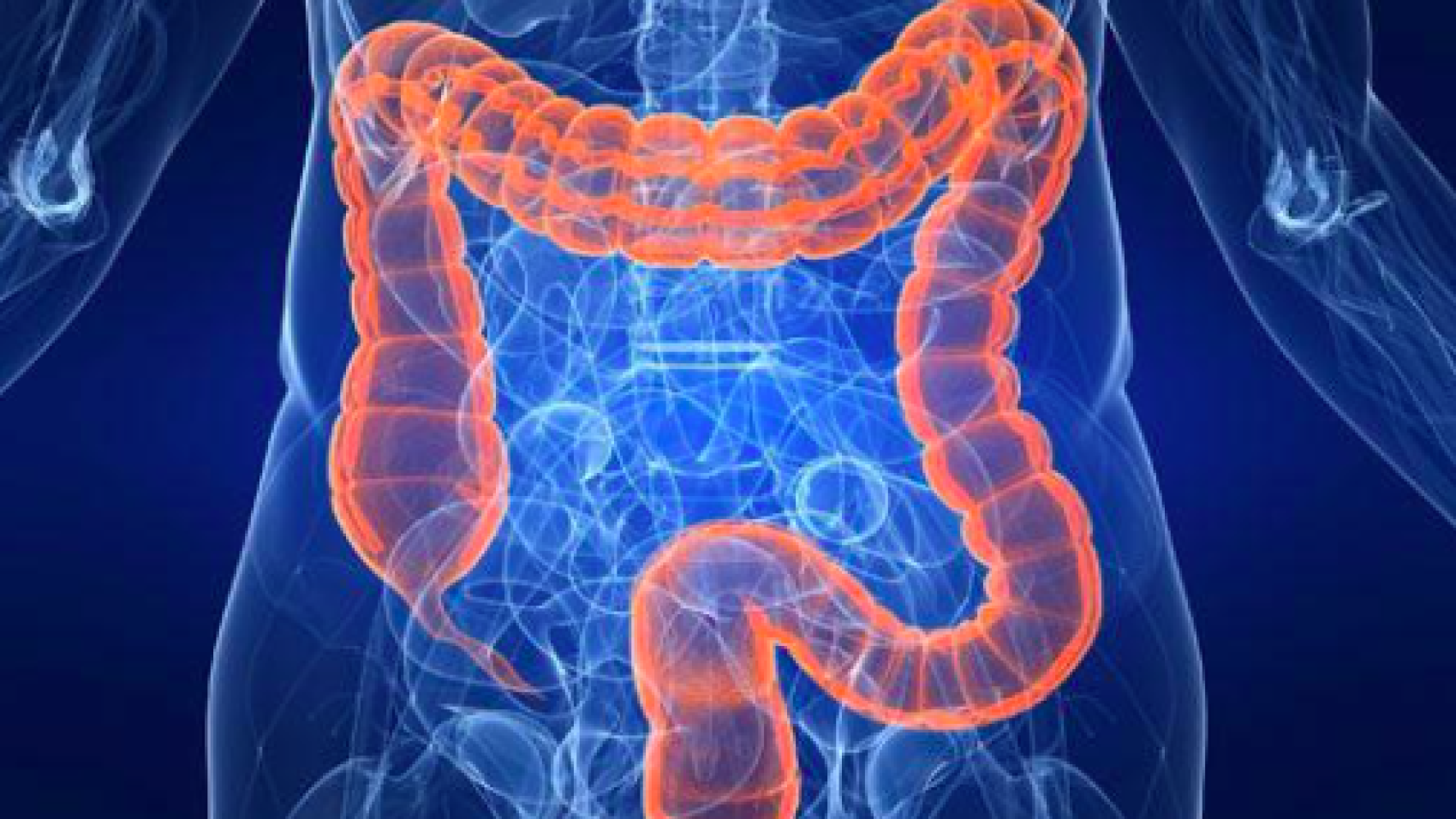
Исследователи рака прямой кишки совершили грандиозный подвиг, продемонстрировав в крупном клиническом испытании, что пациенты так же хорошо обходятся без лучевой терапии, как и с ней.
Результаты, обнародованные в воскресенье на ежегодном собрании Американского общества клинической онкологии и опубликованные в журнале New England Journal of Medicine, могут ежегодно давать более 10 000 пациентов в Соединенных Штатах возможность отказаться от лечения рака, которое может иметь серьезные последствия. серьезные побочные эффекты.
Это исследование является частью нового направления для исследователей рака, сказал доктор Эрик Винер, президент онкологической организации, но не участвовавший в испытаниях.
«Теперь, когда методы лечения рака улучшились, исследователи начинают задавать другие вопросы», — сказал он. «Вместо того, чтобы спрашивать, как можно усилить терапию рака, они спрашивают, есть ли элементы успешного лечения, которые можно исключить, чтобы обеспечить пациентам лучшее качество жизни».
Тем не менее, как показало исследование, лучевая терапия не улучшала результаты. После медианы наблюдения в пять лет не было обнаружено различий в ключевых показателях — продолжительности выживания без признаков рецидива рака и общей выживаемости — между группой, получавшей лечение, и группой, не получавшей лечения. И через 18 месяцев не было никакой разницы между двумя группами в качестве жизни.
Для специалистов по раку толстой и прямой кишки результаты могут изменить жизнь их пациентов, сказал доктор Кимми Нг, содиректор центра рака толстой и прямой кишки в Институте рака Дана-Фарбер, который не был автором исследования.
«Теперь, особенно когда пациенты становятся все моложе и моложе, действительно ли им нужно облучение?» она спросила. «Можем ли мы выбирать, какие пациенты могут обойтись без этого чрезвычайно токсичного лечения, которое может привести к пожизненным последствиям, таким как бесплодие и сексуальная дисфункция?»
Исследование было сосредоточено на пациентах, у которых опухоли распространились на лимфатические узлы или ткани вокруг кишечника, но не на другие органы. Эта подгруппа пациентов, чей рак считается местнораспространенным, составляет около половины из 800 000 вновь диагностированных пациентов с раком прямой кишки во всем мире.
В ходе исследования 1194 пациента были случайным образом распределены в одну из двух групп. Одна группа получила стандартное лечение, долгое и тяжелое испытание, которое началось с облучения, за которым последовала операция, а затем, после того, как пациенты оправились от операции, химиотерапия по усмотрению их врача.
Другая группа получила экспериментальное лечение, которое сначала состояло из химиотерапии, а затем хирургического вмешательства. По усмотрению врача может быть назначен еще один курс химиотерапии. Этим пациентам делали облучение только в том случае, если первоначальная химиотерапия не уменьшала их опухоли — что происходило всего в 9% случаев.
Однако, не все пациенты подходили для участия в исследовании. Исследователи исключили тех, чьи опухоли казались слишком опасными для химиотерапии и хирургического вмешательства. Эти пациенты получали стандартное лучевое лечение.
Доктор Шраг и доктор Итан Баш из Университета Северной Каролины в Чапел-Хилл также предприняли дополнительный шаг, попросив пациентов сообщить о качестве их жизни: насколько сильно они болели? Сколько у них было усталости? Сколько понос? Была ли у них невропатия — руки и ноги, которые покалывают и теряют чувствительность? Как складывалась их сексуальная жизнь? Симптомы прошли? Через какое время симптомы исчезли?
«Когда 80 процентов пациентов живы через пять лет, мы хотим сказать, что они живут хорошо», — сказал доктор Шраг.
Две группы имели разные симптомы в разное время. Но через два года наметилась тенденция к улучшению качества жизни в группе, получавшей химиотерапию. И по одному показателю — мужской и женской сексуальной функции — группа химиотерапии явно показала себя лучше.
Вначале у тех, кто прошел химиотерапию без облучения, была больше тошнота, рвота и усталость. Год спустя, по словам доктора Баша, группа облучения страдала больше, с усталостью, нарушением половой функции и невропатией.
«Теперь пациенты, пытающиеся решить, хотят ли они лучевую или химиотерапию, могут увидеть, как справились с испытанием участники, и решить, какие симптомы для них важнее всего», — сказал доктор Баш.
Такого рода клинические испытания очень сложны. Это известно как исследование деэскалации, потому что оно убирает стандартное лечение, чтобы увидеть, нужно ли оно. Ни одна компания не будет платить за такое испытание. И, как обнаружили исследователи рака прямой кишки, даже Национальный институт здоровья не решался поддержать их исследование, утверждая, что исследователям никогда не удастся убедить достаточное количество врачей включить пациентов, а даже если бы они это сделали, слишком мало пациентов согласились бы присоединиться, опасаясь это поставит под угрозу их здоровье.
Хотя Национальный институт здравоохранения в конце концов согласился спонсировать исследование, его опасения оправдались — исследователям потребовалось восемь лет, чтобы зарегистрировать 1194 пациента в 200 медицинских центрах.
«Это было невероятно сложно», — сказал доктор Алан Венук из Калифорнийского университета в Сан-Франциско, помогавший планировать исследование.
Доктор Шраг отметил, что для этого требовались «невероятно смелые пациенты» и врачи, уверенные в этичности исследования.
«Вы живете с этим на своей совести», — сказал доктор Шраг.
Радиация уже давно используется как способ предотвращения рецидива рака прямой кишки. Химиотерапия и хирургия часто контролировали болезнь, но слишком часто рак снова возникал в области таза. Могут последовать ужасные последствия — опухоли, разрушающие мочевой пузырь, матку, влагалище.
Добавление радиации устранило рецидив в тазу, но вызвало собственный набор проблем.
Шли годы, и некоторые исследователи начали задаваться вопросом, так ли необходимо излучение. Химиотерапия, хирургия и медицинская визуализация улучшились, и пациентов диагностировали раньше, до того, как их рак стал настолько распространенным.
Доктор Шраг и ее коллеги решили проверить идею устранения радиации с помощью пилотного исследования, которое она назвала «30 смелыми пациентами». Результаты были достаточно обнадеживающими, чтобы послужить поводом для более широкого исследования.
https://www.nytimes.com/2023/06/04/health/rectal-cancer-radiation-treatment.html