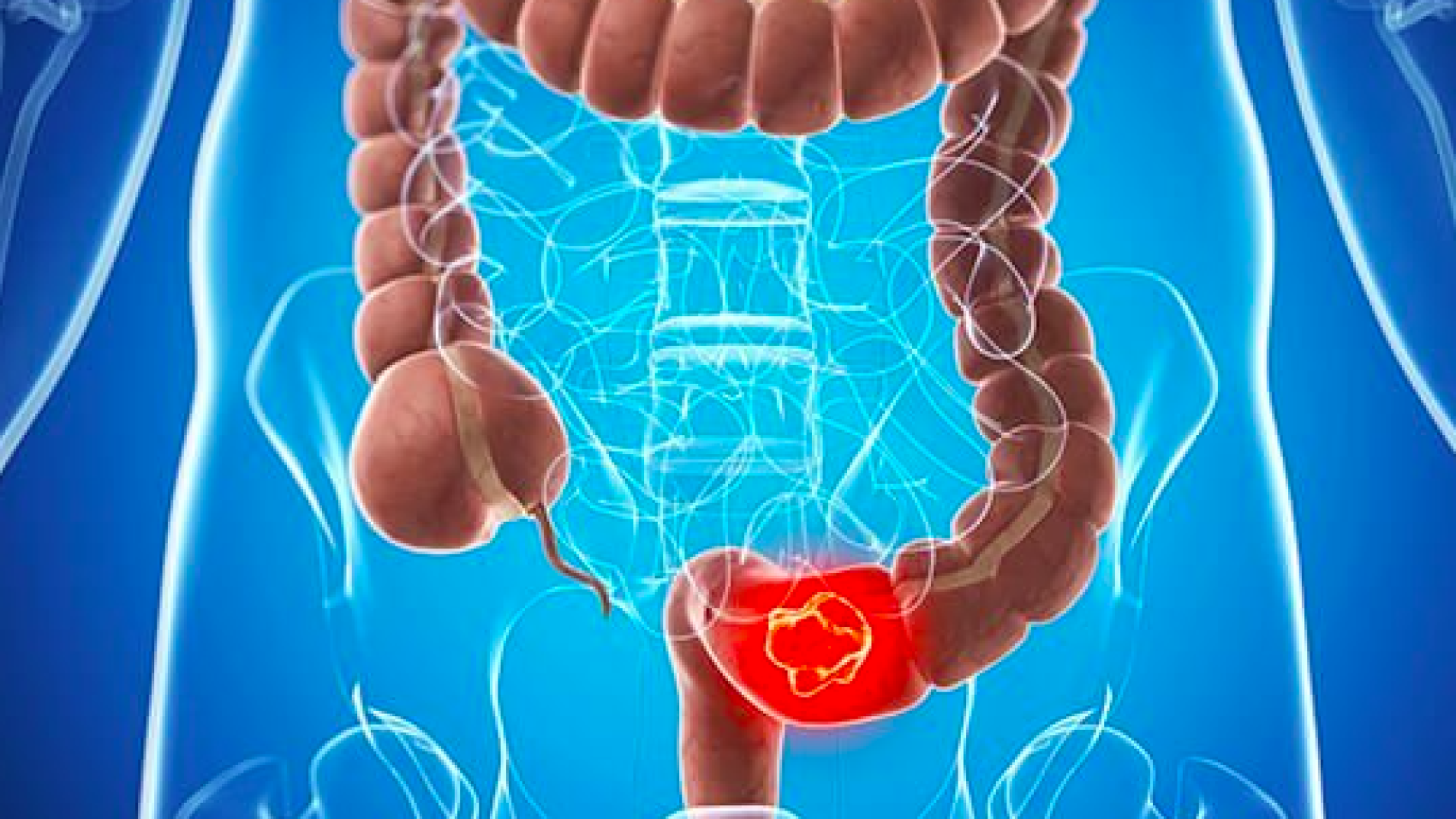
Новое исследование выявило значительную связь между белым хлебом, алкоголем и колоректальным раком, а также некоторыми пищевыми эмульгаторами и раком молочной железы и простаты. Подчеркивая важность сбалансированного питания и осознанного выбора образа жизни, это исследование призывает к переоценке ежедневных привычек потребления и подчеркивает необходимость широкомасштабных образовательных инициатив.
В мире, где наш диетический выбор тщательно изучается, как никогда, недавние исследования дают отрезвляющее представление о связи между повседневными излишествами и одной из самых страшных болезней нашего времени. Комплексное исследование, основанное на данных более чем 118 000 участников Британского биобанка, выявило значительную связь между потреблением белого хлеба, алкоголя и повышенным риском развития колоректального рака.
В основе этого исследования лежит вывод о том, что не только потребление белого хлеба и алкоголя способствуют риску развития колоректального рака, но и некоторые пищевые эмульгаторы, в частности моноглицериды, диглицериды и каррагинан. Эти компоненты, часто скрытые на виду в наших обработанных пищевых продуктах, теперь могут иметь серьезные последствия для правил пищевой промышленности и выбора потребителя в проходе супермаркета. Исследование, в котором также приняли участие французы, подчеркивает глобальную значимость влияния питания на риск развития рака, указывая на необходимость широкомасштабных образовательных инициатив и, возможно, более строгого контроля за использованием пищевых добавок.
Хотя генетика и возраст остаются неконтролируемыми факторами риска, исследование и последующие дискуссии подчеркивают значительное влияние изменяемого образа жизни на риск развития рака. От употребления табака и воздействия ультрафиолета до ожирения и диеты – каждый выбор ведет либо к повышенному риску, либо к профилактической защите. Польза физической активности в сочетании с регулярными обследованиями для раннего выявления подчеркивается как жизненно важные компоненты целостного подхода к профилактике рака.
В конце концов, исследование — это больше, чем просто накопление данных; это настойчивый призыв как к отдельным людям, так и к политикам признать и действовать в соответствии с неоспоримой связью между нашим образом жизни и риском развития рака. Когда мы преодолеваем сложности современной жизни, полученные результаты служат напоминанием о том, что иногда наиболее эффективными профилактическими мерами являются те, которые мы решили включить в нашу повседневную жизнь. Путь к более здоровому будущему начинается с решений, которые мы принимаем сегодня.