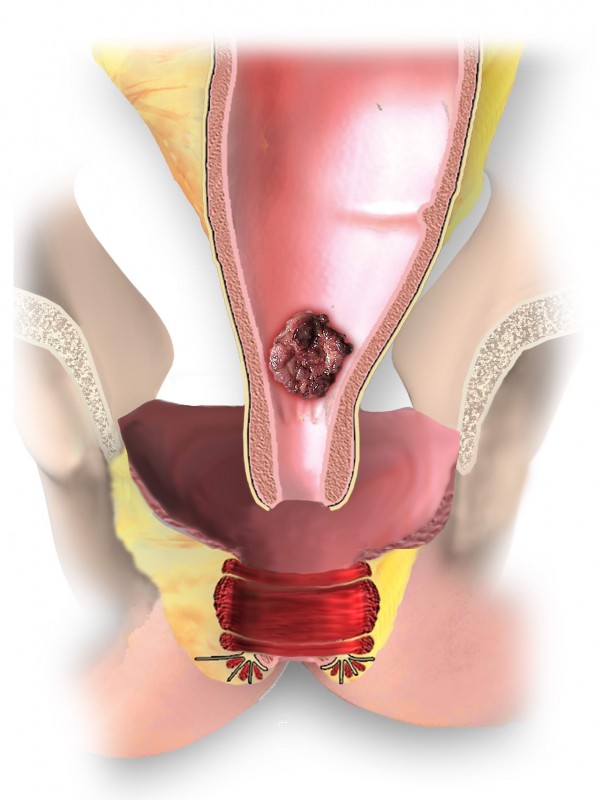
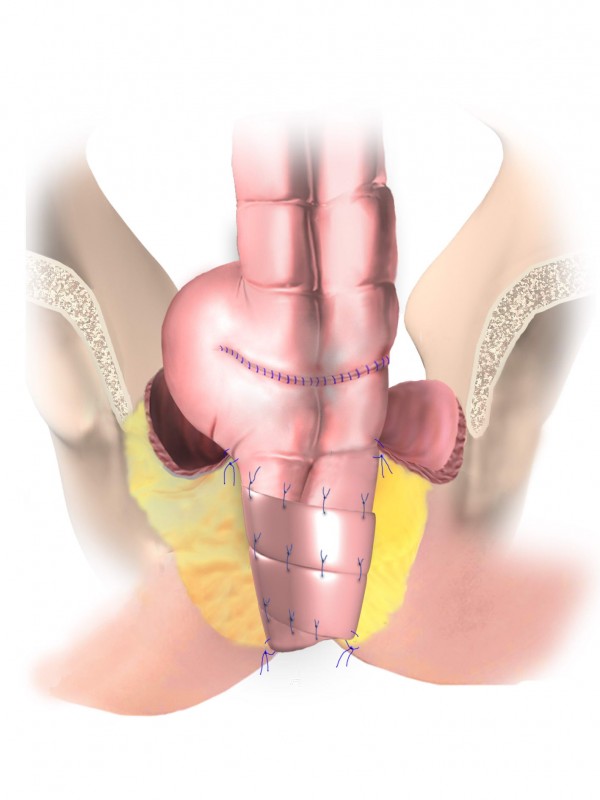
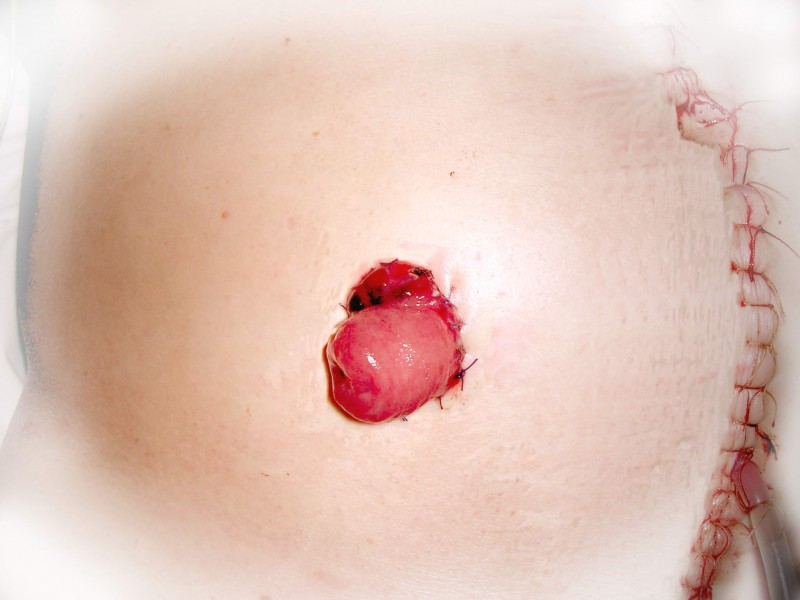
Рак прямой кишки – злокачественная опухоль, развивающаяся из слизистой оболочки прямой кишки. Проблема лечения рака прямой кишки остается одной из самых актуальных и сложных в современной онкологии. Во всем мире наблюдается положительная тенденция роста онкологических заболеваний.
В 2017 году в России зарегистрировано 29918 новых случаев рака прямой кишки, что на 642 (2,1%) случая больше, чем в 2016 году.
Смертность от рака прямой кишки остается на достаточно высоком уровне и в 2017 году составила 16360 новых случаев.
Несмотря на доступность исследования прямой кишки, зачастую опухоли этого органа диагностируются достаточно поздно. Прежде всего, потому что симптомы, возникающие по мере роста опухоли (выделение крови, слизи, ложные позывы или наоборот запоры и т.д.) пациенты связывают с «геморроем» и предпочитают его самостоятельно лечить, тем самым, теряя драгоценное время. Появление указанных жалоб должно настораживать и требует немедленного обращения к врачу, желательно, проктологу.
Дальнейший алгоритм обследования должен заключаться в ректальном осмотре, ректороманоскопии (осмотр прямой кишки с помощью ректоскопа) и назначении колоноскопии. Если в процессе обследования выявилась опухоль, необходимо взять биопсию.
При подтверждении диагноза — рак прямой кишки, требуется выполнение магнитно-резонансной томографии (МРТ) малого таза, ультразвуковым исследованием (УЗИ) ректальным датчиком (при возможности), компьютерной томографии (КТ) брюшной полости с контрастным усилением, КТ грудной клетки, УЗИ брюшной полости, анализ крови на опухолевые маркеры (РЭА, Са 19-9). Все эти исследования необходимы для определения клинической стадии заболевания, что определяет, в последующем, тактику лечения. В плане комплексного обследования выполняется гастроскопия, УЗИ вен нижних конечностей, ЭКГ, УЗИ сердца и т.д.
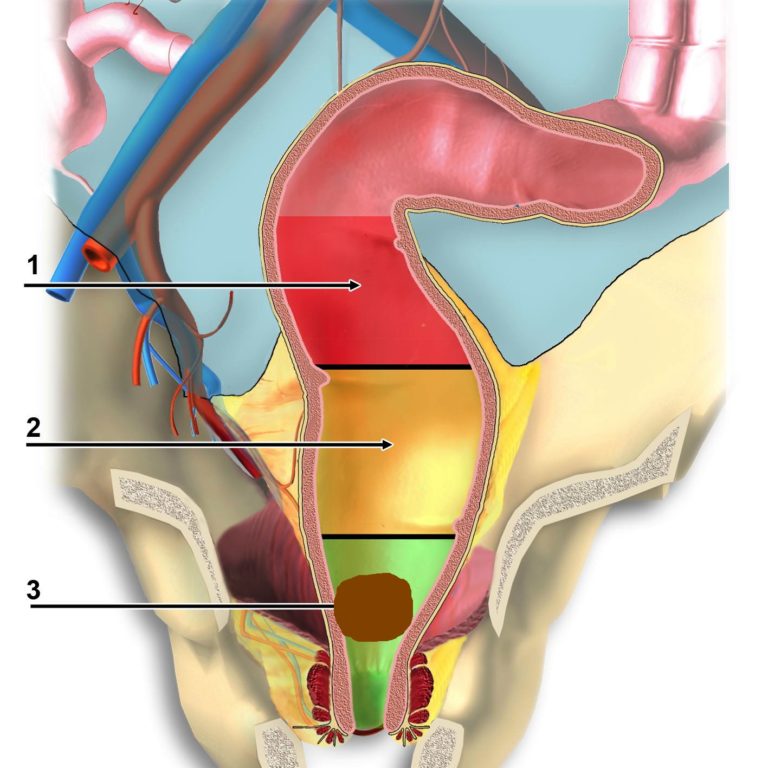
Лечение рака прямой кишки зависит от стадии и расположения опухоли в органе. Прямая кишка подразделяется на четыре отдела: нижнеампулярный – до 5 см от края ануса, среднеампулярный – 5-10 см от края ануса, верхнеампулярный 10-15 см и ректосигмоидный переход – 15-20 см.
Стадирование рака прямой кишки осуществляется с помощью Международной классификации, предложенной Международным Противораковым Союзом в 1989 году с использованием символов TNM. В настоящее время используется классификация TNM (8-е издание, 2018 год):
Т – первичная опухоль.
Тх – первичная опухоль невозможно оценить.
Т0 – нет признаков первичной опухоли.
Tis – рак in situ: интраэпителиальная инвазия или инвазия собственной пластинки.
Т1 – опухоль поражает подслизистую основу.
Т2 – опухоль поражает собственный мышечный слой.
Т3 – опухоль поражает субсерозу или неперитонизированную периректальную клетчатку.
Т3b — глубина прорастания мезоректальной клетчатки не более 5 мм.
Т3c — опухоль прорастает мезоректальную клетчатку на 5–15 мм.
Т3d — опухоль прорастает мезоректальную клетчатку более чем на 15 мм.
Т4 – опухоль поражает другие органы или структуры и/или прорастает в висцеральную брюшину.
Т4а – опухоль прорастает в висцеральную брюшину.
Т4b – опухоль поражает другие органы или структуры.
N – регионарные лимфатические узлы. Регионарными лимфатическими узлами являются периректальные, а также лимфатические узлы, располагающиеся вдоль нижней мезентериальной, прямокишечных и внутренних подвздошных артерий.
Nх – недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 — нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – метастазы в 1-3 регионарных лимфоузлах.
N1а – метастаз в 1 регионарном лимфоузле.
N1b – метастаз в 2-3 регионарных лимфоузлах.
N1с – опухолевые отложения, например сателлиты, в субсерозе или неперитонизированной периректальной кетчатке без метастазов в регионарных лимфоузлах.
N2 – метастазы в 4 или более регионарных лимфоузлах.
N2а – метастазы в 4-6 регионарных лимфоузлах.
N2b – метастазы в 7 или более регионарных лимфоузлах.
Примечание: Если такие депозиты (сателлиты) наблюдаются при опухолях, которые обычно классифицировались как Т1 или Т2, тогда как классификация Т не изменяется, то узелок регистрируется как N1с.
М – отдаленные метастазы.
М0 – отдаленные метастазы не определяются.
М1 – имеются отдаленные метастазы.
М1а – метастаз в пределах одного органа (печень, легкие, яичники, нерегионарные лимфоузлы).
М1b – поражение более одного органа или диссеминация по брюшине
М1с – перитонеальные метастазы самостоятельные или с метастазами в другие органы или анатомические участки.
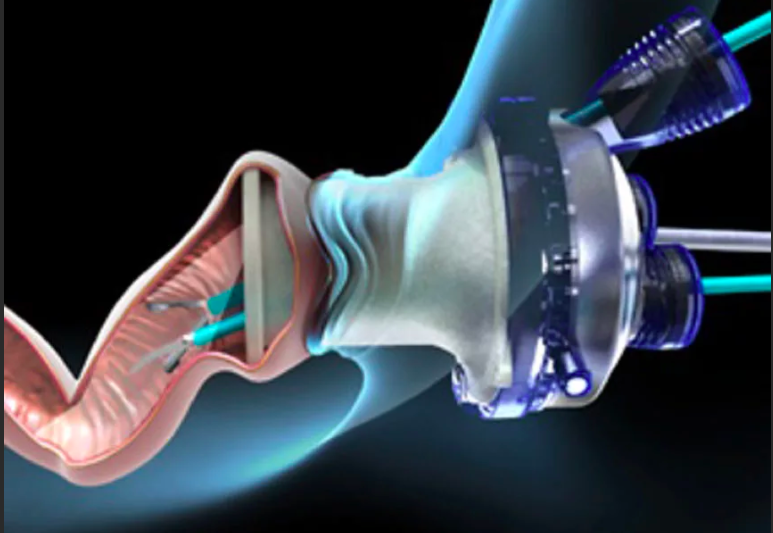
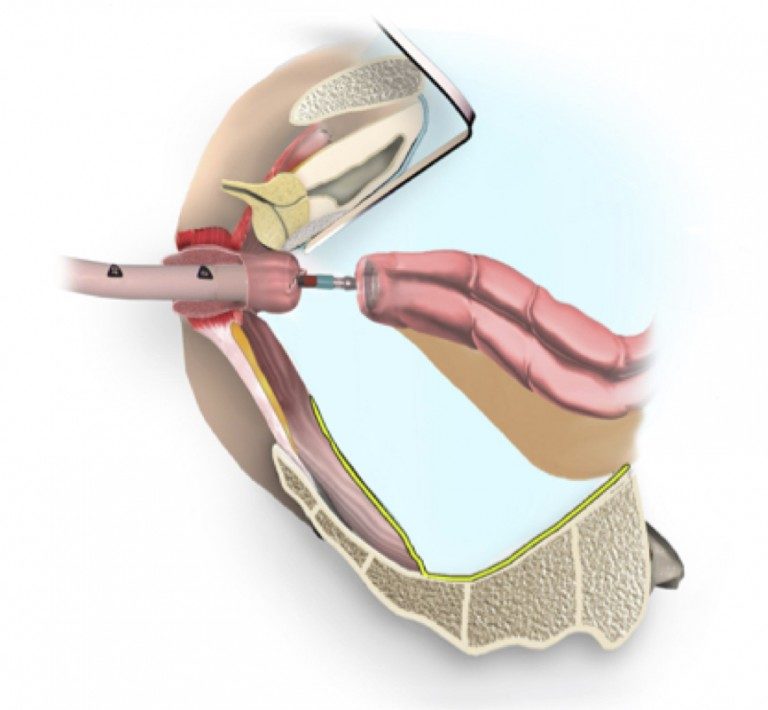
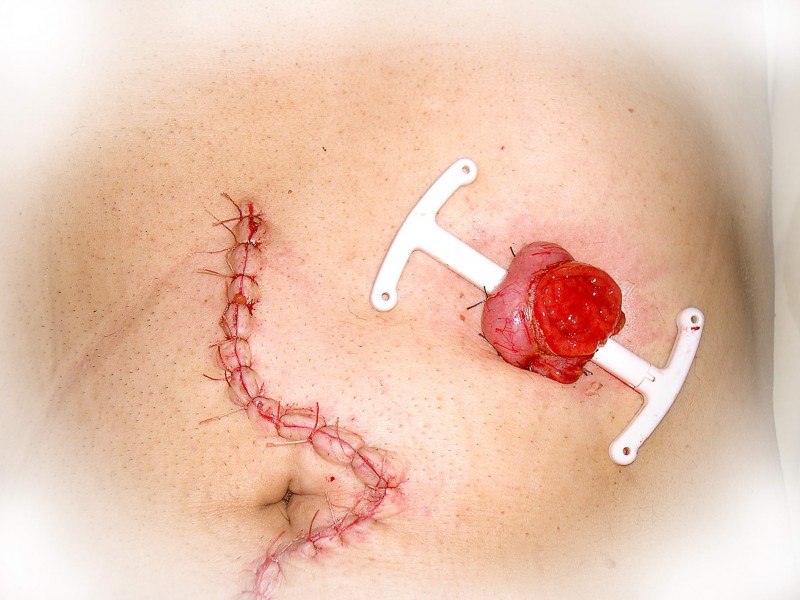
При «раннем» раке прямой кишки необязательно удалять всю прямую кишку. В определенным случаях возможно удаление опухоли через анальный канал с помощью специального оборудования, которое позволяет иссечь новообразование единым блоком со стенкой кишки и подлежащей жировой клетчаткой. Это вмешательство называется Трансанальная ЭндоМикрохирургия (ТЭМ), Трансанальная Эндоскопическая Операция (ТЭО) или TransAnalMiniInvasiveSurgery (TAMIS). Эта операция предполагает сохранение органа при выполнении радикальной операции.