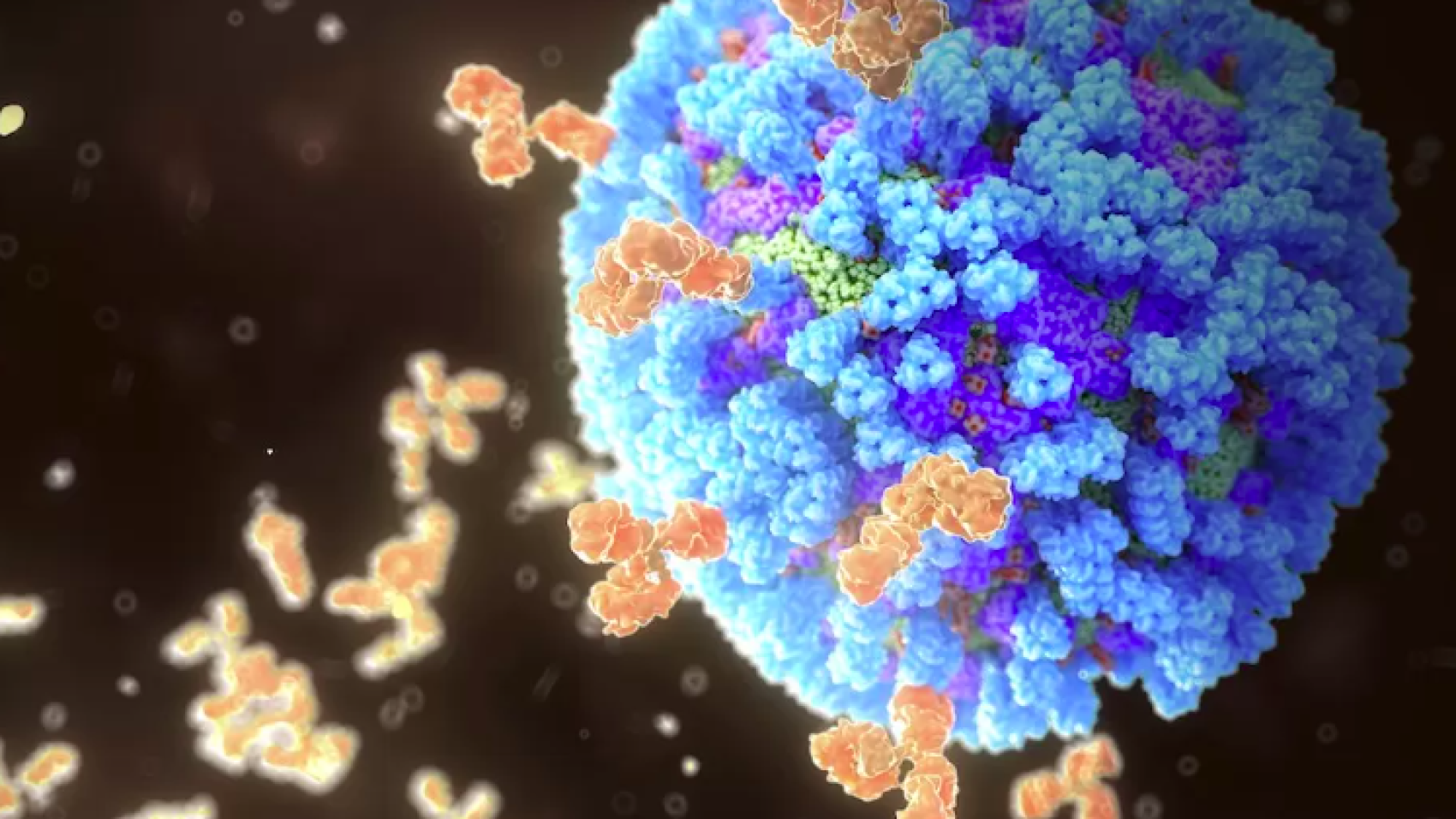
Впервые исследователи выявили два гена – NEK2 и INHBA – которые устойчивы к химиотерапии рака головы и шеи, и обнаружили, что, заглушив их, лечение можно проводить гораздо более эффективно.
Гены, которые способствуют устойчивости к химиотерапии при плоскоклеточном раке головы и шеи (HNSCC), потенциально могут быть подавлены, чтобы существующие методы лечения могли работать.
«К сожалению, есть много людей, которые не реагируют на химиотерапию или радиацию», — сказал старший автор Тех Мюй-Тек из Лондонского университета Королевы Марии. «Наше исследование показало, что, по крайней мере, при раке головы и шеи за этим могут стоять именно эти два конкретных гена, которые затем можно направить на борьбу с химиорезистентностью».
Около 90% случаев рака головы и шеи вызваны HNSCC, а выживаемость пациентов с распространенным HNSCC составляет менее 25%, в основном из-за его резистентности к лечению, включая лучевую терапию и химиотерапию. На сегодняшний день не существует целевых методов лечения, учитывающих генетический состав.
Исследователи протестировали 28 генов на 12 штаммах линий химиорезистентных раковых клеток и остановились на четырех, которые требовали дальнейшего изучения. Они также просмотрели «химическую библиотеку», используемую для разработки новых терапевтических средств, и обнаружили, что гены NEK2 и INHBA можно подавить с помощью грибкового токсина сиродесмина А и карфилзомиба, полученного из бактерий.
В двух из этих четырех генов, NEK2 и INHBA, исследователи смогли использовать сиродесмин А и карфилзомиб, чтобы сделать раковые клетки HNSCC почти в 30 раз более уязвимыми при лечении обычным химиотерапевтическим препаратом цисплатином.
А поскольку сиродесмин А и карфилзомиб уже используются в терапии, исследователи надеются, что их можно будет «перепрофилировать» и адаптировать в качестве дополнения к лечению, чтобы подавить NEK2 и INHBA и предложить более эффективные результаты химиотерапии.
«Эти результаты являются многообещающим шагом на пути к тому, чтобы больные раком в будущем получали персонализированное лечение, основанное на их генах и типе опухоли, что обеспечит им лучшую выживаемость и результаты лечения», — сказал Мюй-Тек.
https://newatlas.com/medical/chemo-resistant-cancer-discovery/